
El cáncer de piel sigue siendo el más incidente en Brasil y en el mundo. Aunque las tasas de curación son altas cuando se detecta precozmente, las terapias convencionales – que implican cirugía o quimioterapia – conllevan una carga significativa para el paciente: el riesgo de mutilaciones estéticas y la toxicidad que afecta a todo el organismo.
Un artículo de revisión de la literatura publicado recientemente en la revista científica Pharmaceutics (2026, v. 18, n. 2) arroja luz, entre otros temas, sobre una estrategia prometedora: el uso de metalofármacos (medicamentos a base de metales) aplicados de forma tópica y más eficiente. El artículo, de autoría de investigadores del CEPID CancerThera, detalla cómo compuestos de oro, plata, platino, paladio, rutenio, vanadio y cobre, cuando se combinan con nanotecnología, pueden incidir sobre los tumores de piel sin agredir el tejido sano.
“Los tratamientos clásicos del cáncer de piel son eficaces, pero tienen limitaciones relevantes: la cirugía puede dejar un impacto estético importante y la quimioterapia sistémica expone a todo el organismo al medicamento, lo que aumenta el riesgo de toxicidad”, explica la Dra. Fernanda van Petten Vasconcelos Azevedo, biomédica e investigadora posdoctoral asociada a CancerThera, autora principal del referido artículo titulado Navigating the challenges of metallopharmaceutical agents: Strategies and predictive modeling for skin cancer therapy (del original en inglés).
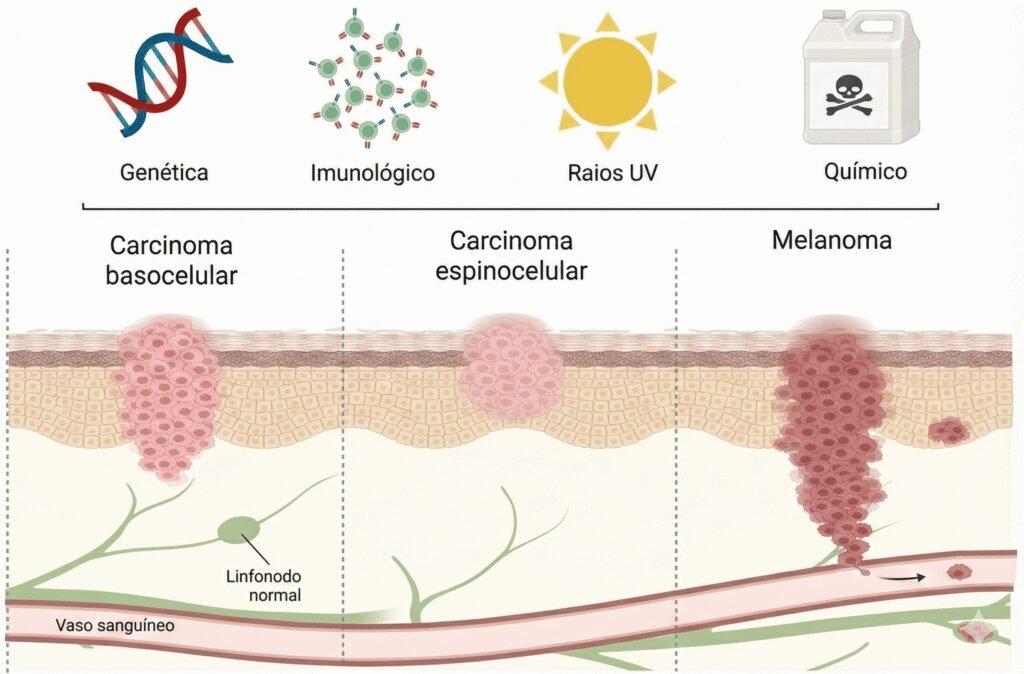
Según ella, es necesario desmitificar la idea de que los metales en la Medicina son una novedad absoluta, citando la cisplatina como ejemplo histórico. Sin embargo, la innovación actual para el cáncer de piel reside en la estrategia de administración: “En lugar de depender solo de la vía sistémica, buscamos metalofármacos diseñados para actuación local y combinados con sistemas de liberación para concentrar el efecto en el tumor cutáneo y minimizar la exposición del resto del cuerpo. Este enfoque busca unir eficacia antitumoral, menor toxicidad sistémica y preservación funcional/estética, que son prioridades claras en tumores de piel”.
El artículo también describe los avances en tecnologías que facilitan la penetración en la piel y protegen la integridad de estos metales, como hidrogeles, microagujas, membranas de nanocelulosa bacteriana y nanopartículas (como liposomas y micelas). Además, los autores examinan el papel de la terapia fotodinámica y el uso de modelado matemático y computacional para simular el transporte de medicamentos y prever su distribución en el organismo. El objetivo de estas estrategias es unir la innovación fisicoquímica a la aplicación clínica, posibilitando tratamientos más selectivos, estables y accesibles.
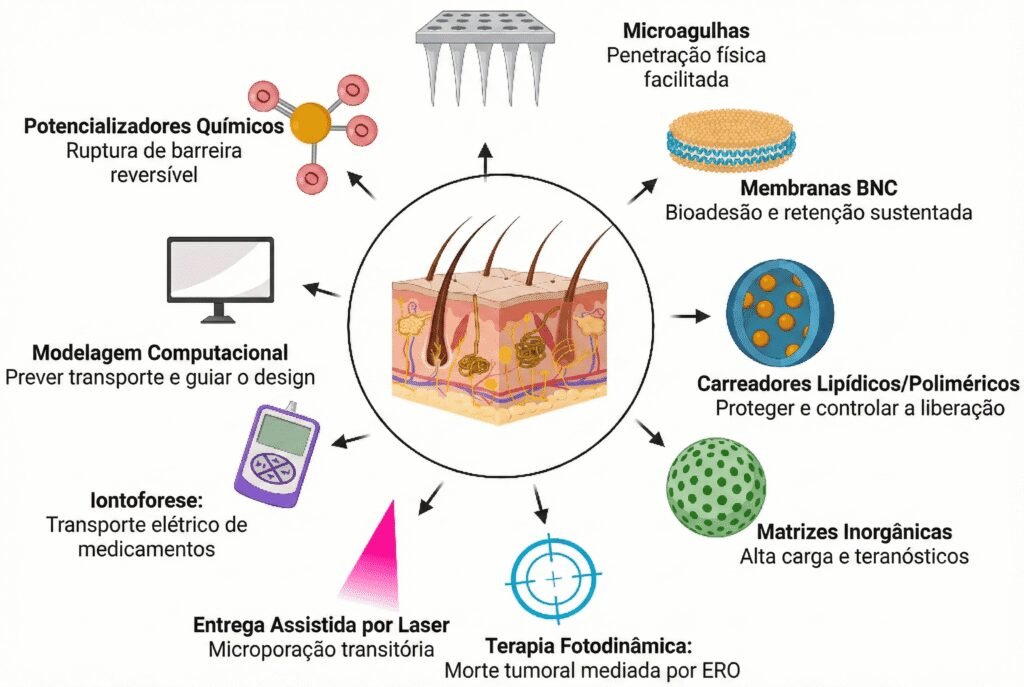
Superando barreras: microagujas y membranas de nanocelulosa
La revisión señala que la eficacia de los compuestos metálicos está en la capacidad de generar un desequilibrio fatal dentro de las células tumorales. Mientras que las células sanas pueden manejar ciertas cargas de metales, las tumorales, que ya operan al límite, colapsan. Azevedo detalla el mecanismo: “Las células del cáncer ya viven bajo mucho estrés, porque crecen rápido y funcionan de manera desorganizada. Los compuestos metálicos aumentan aún más este estrés interno – un proceso llamado ‘estrés oxidativo’ – que perjudica el funcionamiento normal de la célula tumoral”. Ella complementa que estos compuestos dañan el ADN de la célula cancerígena, impidiendo su multiplicación: “Con la acumulación de estrés interno y el daño al ADN, la célula del tumor pierde el control de sus mecanismos de supervivencia y termina muriendo. Como las células cancerígenas son más sensibles a este tipo de daño que las células normales de la piel, este mecanismo permite atacar preferentemente el tumor”.
El origen superficial de los principales tipos de cáncer de piel, como carcinomas y melanoma, favorece la aplicación de estrategias de tratamiento local, permitiendo que medicamentos potentes, como los metalofármacos, sean dirigidos específicamente a la lesión. Al concentrar la acción del fármaco en el área del tumor, es posible aumentar la eficacia terapéutica y, simultáneamente, evitar que la sustancia circule por todo el organismo, lo que reduce la toxicidad sistémica y garantiza mayor seguridad al paciente.
Sin embargo, el desafío de la aplicación tópica (en cremas o parches) es superar la capa más externa de la piel, el estrato córneo, que actúa como una barrera protectora. “En el caso de los metalofármacos, factores fisicoquímicos, como tamaño molecular, carga eléctrica, solubilidad y estabilidad química, pueden limitar su penetración. Incluso compuestos con alta actividad antitumoral pueden tener dificultad para atravesar la piel en cantidad suficiente para alcanzar el tumor”, resalta la biomédica.
Para sortear esto, el artículo enumera tecnologías físicas como las microagujas – dispositivos diminutos que crean canales indoloros en la piel. “En el tratamiento del cáncer de piel, las microagujas facilitan la entrega localizada y controlada de metalofármacos, ayudando a vencer la barrera natural de la piel. Se consideran prometedoras porque causan molestias y dolor mínimos en comparación con las inyecciones tradicionales”, afirma la investigadora.
Otra línea tecnológica abordada en el artículo es el uso de membranas de nanocelulosa bacteriana. Un grupo de investigación activo en CancerThera ya obtuvo éxito preclínico con un complejo de plata y nimesulida incorporado a estas membranas, que funcionan como un “parche” terapéutico.
La Dra. Carmen Silvia Passos Lima, oncóloga y hematóloga, profesora de la Facultad de Ciencias Médicas de la Universidad Estatal de Campinas (Unicamp) e investigadora principal en CancerThera, destaca la eficiencia de este sistema en el mantenimiento del tratamiento. “Las membranas de nanocelulosa bacteriana utilizadas en un estudio anterior realizado por nosotros tienen gran importancia, pues proporcionan la liberación sostenida de dosis equivalentes del fármaco – en este caso, el complejo de plata – sobre el tumor”, explica. “Esto hace que no sea necesario sustituir el parche con frecuencia, ahorrando así recursos financieros sin perder la eficacia del tratamiento”, evalúa.
El futuro es digital y clínico
El artículo también resalta la importancia del modelado matemático y computacional para prever hasta dónde penetra el medicamento en la piel – optimizando las dosis incluso antes de las pruebas biológicas –, pudiendo demostrar qué nuevos fármacos pueden indicarse para el tratamiento de tumores cutáneos superficiales o profundos: “Los modelos desarrollados para prever la profundidad que el medicamento alcanza en la piel son de gran interés, pues podrán ahorrar los estudios convencionales de permeabilidad de fármacos en membranas sintéticas que simulan la piel humana o en piel de animales”, señala Lima.
La investigadora afirma, además, que es fundamental que estos modelos sean validados por evaluaciones convencionales de penetración de fármacos en capas de la piel (como las mencionadas) y en estudios preclínicos en animales pequeños para que, solo entonces, se utilicen en la práctica clínica.
En cuanto a la llegada de estas innovaciones a los pacientes, la profesora revela que la ciencia ya está saliendo del laboratorio hacia el hospital. “Considerando que ya hemos observado que las membranas de nanocelulosa impregnadas con el complejo de plata fueron eficaces, reduciendo sustancialmente el tamaño de los tumores, y se mostraron seguras en ratones (desprovistas de toxicidad local o sistémica o con toxicidad aceptable), el siguiente paso es el estudio clínico – en humanos”.
Este estudio, informa, ya está siendo realizado en el Hospital de Clínicas de la Unicamp por investigadores del CancerThera en pacientes con tumor de piel – específicamente carcinoma de células escamosas. Con la farmacéutica e investigadora posdoctoral Gisele Goulart da Silva al frente de los procedimientos y bajo la supervisión de Lima, el estudio contempla dos fases: la primera verificará la dosis adecuada del complejo de plata en membrana de nanocelulosa a ser administrada a los pacientes; la segunda evaluará la eficacia del tratamiento.
“Los parches impregnados con el complejo de plata solo podrán llegar a farmacias y hospitales si los resultados del estudio clínico indican que el tratamiento es eficaz y seguro para uso en humanos y tras la aprobación de la Agencia Nacional de Vigilancia Sanitaria (Anvisa)”, advierte Lima.
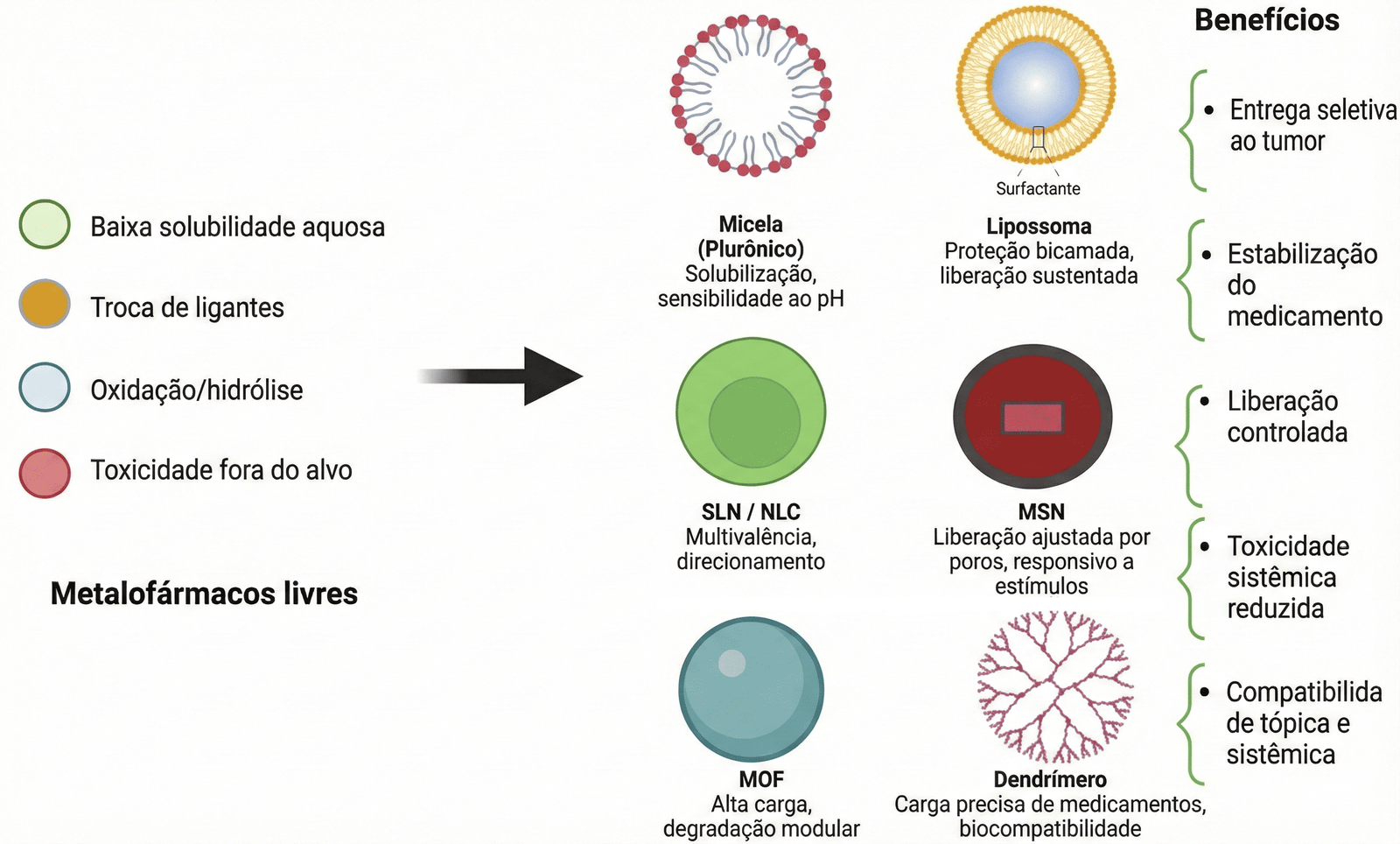
Curiosidades metálicas
- No es solo joyería: Además de oro y plata, metales como rutenio, cobre y vanadio están siendo explorados en la composición de fármacos. Cada uno posee una “firma” química diferente, permitiendo atacar tumores que han desarrollado resistencia a tratamientos comunes.
- La piel es un escudo: El estrato córneo, la capa más externa de la piel, tiene un grosor aproximado al de una hoja de papel de seda (10 a 20 micrómetros), pero es increíblemente eficiente en impedir la entrada de sustancias. Por eso tecnologías como las microagujas son esenciales.
- Bacterias “tejedoras”: La nanocelulosa utilizada en los apósitos citados en el estudio es producida por bacterias (como las del género Komagataeibacter). Ellas tejen una red de fibras purísimas, mucho más finas que un cabello, capaces de retener agua y medicamento, creando un ambiente ideal para el tratamiento.
- Agujas que desaparecen: Algunas de las microagujas citadas en el estudio son “disolubles”. Hechas de polímeros biocompatibles, penetran la piel, liberan la carga necesaria de metalofármaco y desaparecen sin dejar residuos, eliminando los desechos hospitalarios de agujas punzocortantes.
Autores del artículo
Fernanda van Petten Vasconcelos Azevedo | Facultad de Ciencias Médicas, Universidad Estatal de Campinas (Unicamp), Campinas, Brasil.
Ana Lúcia Tasca Gois Ruiz | Facultad de Ciencias Farmacéuticas, Universidad de Campinas, Campinas, Brasil.
Diego Samuel Rodrigues | Facultad de Tecnología, Universidad Estatal de Campinas (Unicamp), Campinas, Brasil.
Douglas Hideki Nakahata | Centro Internacional de Física de Donostia – DIPC, Donostia, Gipuzkoa, España.
Raphael Enoque Ferraz de Paiva | Centro Internacional de Física de Donostia – DIPC, Donostia, Gipuzkoa, España; y Departamento de Química, Facultad de Ciencias, Universidad Autónoma de Barcelona, Cerdanyola del Vallès, Barcelona, España.
Daniele Ribeiro de Araujo | Departamento de Biofísica, Escuela Paulista de Medicina, Universidad Federal de São Paulo (Unifesp), São Paulo, Brasil.
Ana Carola de La Via | Centro de Ciencias Naturales y Humanas, Universidad Federal del ABC (UFABC), Santo André, Brasil.
Wendel Andrade Alves | Centro de Ciencias Naturales y Humanas, Universidad Federal del ABC (UFABC), Santo André, Brasil.
Michelle Barreto Requena | Instituto de Física de São Carlos (IFSC), Universidad de São Paulo (USP), São Carlos, Brasil.
Cristina Kurachi | Instituto de Física de São Carlos (IFSC), Universidad de São Paulo (USP), São Carlos, Brasil.
Mirian Denise Stringasci de Azevedo | Instituto de Física de São Carlos (IFSC), Universidad de São Paulo (USP), São Carlos, Brasil.
José Dirceu Vollet-Filho | Instituto de Física de São Carlos (IFSC), Universidad de São Paulo (USP), São Carlos, Brasil.
Wilton Rogério Lustri | Instituto de Biociencias, Universidad de Araraquara (Uniara), Araraquara, Brasil.
Vanderlei Salvador Bagnato | Instituto de Física de São Carlos (IFSC), Universidad de São Paulo (USP), São Carlos, Brasil.
Camilla Abbehausen | Instituto de Química, Universidad Estatal de Campinas (Unicamp), Campinas, Brasil.
Pedro Paulo Corbi | Instituto de Química, Universidad Estatal de Campinas (Unicamp), Campinas, Brasil.
Carmen Silvia Passos Lima | Facultad de Ciencias Médicas, Universidad Estatal de Campinas (Unicamp), Campinas, Brasil.
Texto: Romulo Santana Osthues








